
Co skłoniło panią do zajęcia się akurat tym tematem?
W trakcie studiów doktoranckich zaproponowano mi udział w grancie badawczym OPUS 19. Temat wydał mi się wyjątkowo ciekawy ze względu na aspekt aplikacyjny. Jednocześnie, pod względem badawczym, jest to stosunkowo nowy temat również na świecie, stąd także chęć do realizacji tych badań. Sam projekt badawczy był bardzo szeroki, więc wiedziałam, że jest to dla mnie duża możliwość rozwoju.
Czym jest polimeraza DNA theta?
W organizmie ludzkim, w każdej komórce występują białka, które są odpowiedzialne za podstawowe funkcje pozwalające nam przeżyć. Polimeraza DNA theta jest jednym z takich białek. Dokładnie jest to enzym, który odpowiada za syntezę DNA podczas jego naprawy. Ogólnie polimerazy DNA to szeroka grupa białek, a dokładnie enzymów umożliwiających syntezę DNA w trakcie jego naprawy oraz replikacji. Replikacji, czyli podstawowego procesu, który pozwala na powielenie DNA, aby następnie podczas podziału komórki mógł zajść podział tego materiału genetycznego na komórki potomne. Gdyby nie zdolność naprawy DNA to prawdopodobnie jego uszkodzeń byłoby na tyle dużo, że komórka by umierała. Naukowcy odkryli, że polimeraza DNA theta jest przede wszystkim zaangażowana w proces naprawy dwuniciowych pęknięć DNA, biorący nazwę od tego białka czyli łączenie końców zależne od polimerazy theta (z ang. polymerase theta-mediated end joining).
 Schemat procesu, w który zaangażowana jest polimeraza DNA theta
Schemat procesu, w który zaangażowana jest polimeraza DNA theta
I do jakich wniosków doszliście?
Są to badania wstępne. Aby faktycznie bezpośrednio przełożyły się na terapię przeciwnowotworową musiałoby nastąpić jeszcze bardzo dużo procesów. Badania przeprowadzone były w głównej mierze na komórkach nowotworowych, czyli in vitro. Powinniśmy następnie rozszerzyć badania in vivo, czyli na zwierzętach, a później przeprowadzić badania kliniczne, już na pacjentach i osobach zdrowych. Jednak już teraz z moich badań można wywnioskować, że kombinacje leków, których użyłam, czyli inhibitory polimerazy DNA theta, wraz z inhibitorami innych białek zaangażowanych w naprawę DNA, czyli polimerazy ADP-rybozy (w skrócie PARP) lub RAD52, prowadzą do śmierci komórek nowotworowych. W świecie naukowym PARP to szeroko badana grupa białek i już funkcjonuje w terapiach przeciwnowotworowych, szczególnie jajnika i piersi. Główny mankament tego leczenia jest taki, że komórki nowotworowe uodparniają się na te inhibitory, stąd też tak duże zainteresowanie inhibitorami polimerazy DNA theta – może być ona drugim celem terapeutycznym, który pomoże w walce z opornością na inhibitory PARP. W swoich badaniach używałam kombinacji tych leków wraz z chemioterapeutykiem. Dla glejaka był to temozolomid, a dla czerniaka – dakarbazyna. Leki te są rutynowo stosowane w leczeniu chemioterapeutycznym wymienionych nowotworów. Naszym celem było zbadanie, jaki wpływ ma każdy z tych czynników oddzielnie, jak i ich kombinacja.
Okazało się, że kombinacja dwóch inhibitorów dość skutecznie zabija komórki nowotworowe, czyli jej działanie jest istotnie statystycznie wyższe w porównaniu do zastosowania pojedynczych leków w większości otrzymanych wyników. Dodanie do tego chemioterapeutyku jeszcze zwiększa ten efekt. Natomiast, co istotne, kombinacje te wpływają w dużo mniejszym stopniu na komórki prawidłowe, czyli zdrowe. Jest to klucz do precyzyjnej terapii, która miałaby celować tylko w nowotwory, a nie szkodzić zdrowym tkankom w organizmie człowieka. Mogłoby się to stać realną terapią przeciwnowotworową dla pacjentów.
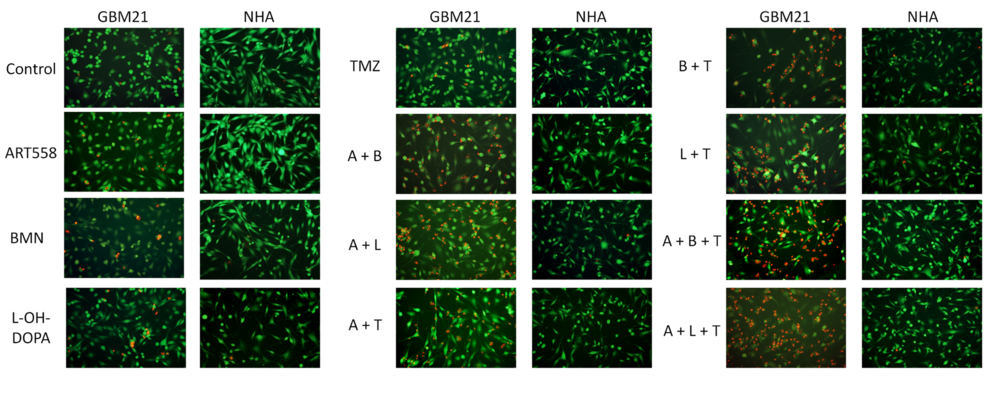 Efekt działania inhibitora polimerazy DNA theta (ART558), inhibitora PARP (BMN), inhibitora RAD52 (L-OH-DOPA), związku cytotoksycznego temozolomidu (TMZ) oraz ich kombinacji na komórki glejaka (GBM21) oraz komórki prawidłowe (NHA) zwizualizowany na mikroskopie fluorescencyjnym za pomocą podwójnego barwienia jodkiem propidyny i kalceiną AM. Komórki żywe wybarwione są na zielono, a komórki z zaburzoną integralnością błony komórkowej na czerwono
Efekt działania inhibitora polimerazy DNA theta (ART558), inhibitora PARP (BMN), inhibitora RAD52 (L-OH-DOPA), związku cytotoksycznego temozolomidu (TMZ) oraz ich kombinacji na komórki glejaka (GBM21) oraz komórki prawidłowe (NHA) zwizualizowany na mikroskopie fluorescencyjnym za pomocą podwójnego barwienia jodkiem propidyny i kalceiną AM. Komórki żywe wybarwione są na zielono, a komórki z zaburzoną integralnością błony komórkowej na czerwono
Czy jest szansa na wdrożenie pani odkryć w leczeniu nowotworów?
Inhibitory polimerazy DNA theta już są w badaniach klinicznych jako związki o potencjale przeciwnowotworowym, więc to też pokazuje praktyczny aspekt i szansę wejścia do prawdziwej terapii przeciwnowotworowej. Moje badania, może niebezpośrednio niestety, mają szansę wejścia w praktykę leczenia nowotworów. Cieszę się z tego, bo mają wkład w poszerzenie wiedzy z tej dziedziny. Według mojej wiedzy, jesteśmy pierwszym zespołem, który badał zastosowanie tych inhibitorów w leczeniu nowotworów mózgu i skóry. Nie ma takich publikacji, przynajmniej publicznie dostępnych, i to na pewno jest nowum.
Przy realizacji swoich badań współpracowała Pani z różnymi ośrodkami zewnętrznymi. W jaki sposób ta współpraca się odbywała?
Współpracowaliśmy z trzema jednostkami Uniwersytetu Medycznego: Zakładem Biochemii Medycznej, pod kierownictwem prof. Janusza Szemraja, w którym odbywała się część badań, Kliniką Neurochirurgii i Chirurgii Nerwów Obwodowych, od której otrzymywaliśmy do badań materiał glejaka, i Kliniką Chirurgii Onkologicznej, od której uzyskiwaliśmy materiał czerniaka. Z kolei dr Grażyna Hoser z Zakładu Immunologii Transplantacyjnej i Eksperymentalnej Intensywnej Terapii Centrum Medycznego Kształcenia Podyplomowego w Warszawie stanowiła dla nas zaplecze merytoryczne i z nią wykonywaliśmy badania in vivo.
Współpraca z prof. Tomaszem Skorskim z Department of Microbiology and Immunology and Fels Institute for Cancer Research and Molecular Biology Lewis Katz School of Medicine z Temple University of Philadelphia w Stanach Zjednoczonych również miała charakter merytoryczny. Pan Profesor jest specjalistą w tym temacie i był dla nas źródłem wiedzy oraz cennych, najnowszych informacji.
Czy badania, które pani prowadziła do pracy doktorskiej będą w jakiś sposób kontynuowane?
Tak, są takie plany. Wstępnie wiadomo, że kontynuacja będzie rozszerzeniem dokładnie tych samych badań, ale na nowotwór trzustki, który jest trudny w leczeniu i powoduje wysoką umieralność. Dlatego, jeżeli moglibyśmy przyczynić się do zwiększenia jego wyleczalności, byłoby to bardzo cenne. Chcielibyśmy także zrealizować badania w obrębie tych samych nowotworów, ale na większej liczbie linii komórkowych, czyli rozszerzyć skalę badań, by jeszcze potwierdzić uzyskane wyniki. Jak wiadomo, każdy pacjent jest trochę inny. Kolejny plan na kontynuację to grant, o który wniosek przygotowujemy. Pozwoliłoby to na sfinansowanie rozszerzenia badań o kolejne czynniki, mogące przyczynić do lepszego zbadania mechanizmu działania polimerazy DNA theta i całej terapii. Badania te wymagają dużego nakładu finansowego i granty z Narodowego Centrum Nauki są znakomitym źródłem wsparcia.
Jakie są Pani plany po obronie doktoratu?
Chciałabym zostać jak najbliżej nauki i szukam pracy w firmach farmaceutycznych. To bardzo ważne, że można wykorzystać zdobytą na uczelni wiedzę do realnego wpływu na powstawanie leków i terapii, a także na kształt prowadzenia badań w formie komercyjnej – takich, które trafiają potem do pacjentów.
Dziękuję za rozmowę. Mamy nadzieję, że prowadzone badania przez panią badania realnie przyczynią się do zwiększenia skuteczności leczenia nowotworów.
Dr inż. Gabriela Barszczewska-Pietraszek – odbywała studia doktoranckie w Stacjonarnym Studium Doktoranckim Genetyki Molekularnej, Cytogenetyki i Biofizyki Medycznej w Katedrze Genetyki Molekularnej Instytutu Biochemii na Wydziale Biologii i Ochrony Środowiska Uniwersytetu Łódzkiego. Rozprawę doktorską przygotowała pod kierownictwem prof. dr. hab. Tomasza Śliwińskiego z Katedry Genetyki Molekularnej Instytutu Biochemii Wydziału Biologii i Ochrony Środowiska UŁ oraz dr n. biol. Piotra Czarnego z Zakładu Biochemii Medycznej Uniwersytetu Medycznego w Łodzi.

Redakcja: Kamila Knol-Michałowska, Centrum Promocji, Wydział Biologii i Ochrony Środowiska UŁ
Materiał i grafiki: Gabriela Barszczewska-Pietraszek, Wydział Biologii i Ochrony Środowiska UŁ
